
Secondo l’ultimo rapporto del Ministero della Salute, l’Italia detiene il triste primato in Europa sul consumo di antibiotici.
La diretta conseguenza di ciò è che anche la percentuale di resistenza in Italia si mantiene più alta rispetto alla media europea, sebbene il trend sia in leggero calo.
COS’ È LA AMR
Con il termine antibiotico-resistenza ci si riferisce all’insieme di meccanismi messi in atto dai batteri nei confronti dei farmaci (gli antibiotici) somministrati per contrastare le infezioni di cui sono causa.
Per comprendere il problema della AMR, è utile discutere alcuni concetti rilevanti.
In primo luogo, la resistenza antimicrobica è un fenomeno antico ed è il risultato dell’interazione di molti organismi con il loro ambiente. La maggior parte dei composti antimicrobici sono molecole prodotte naturalmente e, come tali, i batteri co-residenti hanno sviluppato meccanismi per superare la loro azione al fine di sopravvivere. Pertanto, questi organismi sono spesso considerati “intrinsecamente” resistenti a uno o più antimicrobici.
In secondo luogo, è importante riconoscere che il concetto di resistenza/suscettibilità antimicrobica nella pratica clinica è un fenomeno relativo e con molti livelli di complessità. La definizione di breakpoints di suscettibilità clinica (suscettibile, intermedio e resistente) si basa principalmente sull’attività in vitro di un antibiotico contro un campione batterico considerevole. Tuttavia, questa va combinata con alcuni parametri farmacologici (ad esempio, concentrazioni nel sangue e nel sito di infezione dell’antimicrobico, tra gli altri). Pertanto, quando si trattano batteri resistenti agli antibiotici, l’interpretazione dei modelli di suscettibilità può variare in base allo scenario clinico e alla disponibilità di opzioni di trattamento.
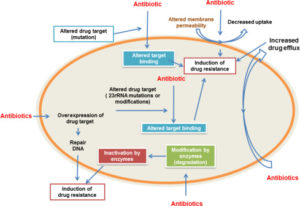
BASI GENETICHE DELLA AMR
I batteri hanno una notevole plasticità genetica. Questa caratteristica consente loro di rispondere a una vasta gamma di minacce ambientali, compresa la presenza di molecole antibiotiche che possono mettere a rischio la loro esistenza.
I batteri usano due principali genetiche strategie per contrastare l’attività degli antibiotici:
- mutazioni nei geni spesso associati al meccanismo d’azione del composti (Mutational resistance);
- acquisizione di DNA estraneo codificante per enzimi di resistenza attraverso il trasferimento genico orizzontale (Horizontal Gene Transfer – HGT).
MUTATIONAL RESISTANCE (MR)
La MR si verifica quando, a partire da una popolazione batterica suscettibile a un dato antibiotico, si viene a creare un sottogruppo di batteri che sviluppa mutazioni genetiche che influenzano l’attività dell’antibiotico stesso. Si verifica, così, l’aumento del tasso di sopravvivenza della popolazione batterica mutata in seguito all’esposizione ad un agente antimicrobico rispetto a quella dei batteri che non hanno sviluppato la mutazione.
In molti casi, i cambiamenti mutazionali che portano alla resistenza sono costosi per l’omeostasi cellulare e vengono mantenuti solo se necessario, ovvero in presenza dell’antibiotico.
In generale, le mutazioni che determinano resistenza antimicrobica alterano l’azione antibiotica attraverso uno dei seguenti meccanismi:
- modifiche del target antimicrobico;
- una diminuzione nell’assorbimento del farmaco;
- attivazione dei meccanismi di efflusso per estrudere la molecola dannosa dalla cellula batterica;
- cambiamenti globali in importanti vie metaboliche attraverso la modulazione delle reti di regolazione.
Pertanto, la resistenza derivante dai cambiamenti mutazionali acquisiti è diversa e varia in complessità.
HORIZONTAL GENE TRANSFER – HGT
L’acquisizione di materiale di DNA estraneo tramite HGT è uno dei meccanismi più importanti dell’evoluzione batterica ed è spesso responsabile dello sviluppo della resistenza antimicrobica.
La maggior parte degli agenti antimicrobici utilizzati nella pratica clinica sono (o derivano da) prodotti naturalmente presenti nell’ambiente (principalmente suolo). Come accennato in precedenza, i batteri che condividono l’ambiente con queste molecole ospitano determinanti genetici intrinseci di resistenza e vi sono solide prove che suggeriscono che tale “resistenza ambientale” è una fonte prolifica per l’acquisizione di geni di resistenza agli antibiotici in batteri clinicamente rilevanti. Inoltre, questo scambio genetico è stato implicato nella diffusione della resistenza a molti antibiotici di uso frequente.
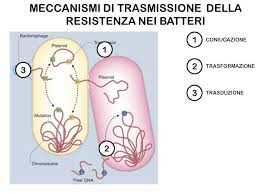
Classicamente, i batteri acquisiscono materiale genetico esterno attraverso tre strategie principali:
- trasformazione (incorporazione di DNA nudo);
- trasduzione (mediata da fagi);
- coniugazione batterico.
TRASFORMAZIONE
La trasformazione è forse il tipo più semplice di HGT, ma solo poch specie batteriche clinicamente rilevanti sono in grado di incorporare “naturalmente” il DNA nudo per sviluppare resistenza.
Infatti, affinché la trasformazione abbia luogo, devono essere soddisfatte diverse condizioni. Deve essere presente del DNA nell’ambiente extracellulare, il batterio ricevente deve essere in uno stato di competenza e il DNA traslocato deve essere stabilizzato o mediante integrazione nel genoma ricevente o mediante ricircolarizzazione (nel caso del DNA plasmidico).
Negli streptococchi, si ritiene che i geni che codificano per la proteina legante la penicillina (PBP) a mosaico (una proteina con ridotta affinità per gli antibiotici β-lattamici) siano il risultato del trasferimento genico da specie simili resistenti alla penicillina. La conseguenza è la resistenza alla penicillina diffusa tra le varie specie di streptococchi.
TRASDUZIONE
Nel caso della trasduzione, i batteriofagi svolgono un ruolo importante nella formazione del microbioma batterico in qualsiasi ambiente. Attraverso la trasduzione specializzata o generalizzata, i batteriofagi possono trasferire geni vantaggiosi per i loro ospiti microbici, promuovendone a loro volta la sopravvivenza e la diffusione. Le sequenze di DNA trasferibili vanno dal DNA cromosomico ad elementi genetici mobili (MGE) come plasmidi, trasposoni e isole genomiche. Esempi di resistenze batteriche insorte tramite questo meccanismo sono il trasferimento della resistenza alla tetraciclina e alla gentamicina tra gli enterococchi ed il trasporto di geni β-lattamasi da parte dei batteriofagi in Escherichia coli e Salmonella.
CONIUGAZIONE
La coniugazione è il trasferimento del DNA attraverso un processo in più fasi che richiede il contatto tra cellule batteriche tramite pili o adesine presenti sulla superficie cellulare. È facilitato d un meccanismo coniugativo codificato da geni presenti su plasmidi replicanti autonomamente o da elementi coniugativi integrativi nel cromosoma batterico.
Questo meccanismo è responsabile della resistenza batterica a numerosi farmaci antimicrobici quali antiobiotici β-lattamici, chinoloni, aminoglicosidi, tetracicline e sulfamidici.
INTEGRONI
Infine, uno dei meccanismi più efficienti per accumulare geni di resistenza antimicrobica è rappresentato dagli integroni, che sono sistemi di ricombinazione sito-specifici in grado di reclutare frame di lettura aperti sotto forma di cassette geniche mobili.
Gli integroni forniscono un meccanismo efficiente e piuttosto semplice per l’aggiunta di nuovi geni nei cromosomi batterici, insieme ai meccanismi necessari per assicurarne l’espressione; una robusta strategia di scambio genetico e uno dei principali driver dell’evoluzione batterica.







